విషయము
ఒకే మూలకం యొక్క అన్ని అణువులలో ఒకే సంఖ్యలో ప్రోటాన్లు ఉన్నప్పటికీ, న్యూట్రాన్ల సంఖ్య మారవచ్చు. ఒక నిర్దిష్ట అణువులో ఎన్ని న్యూట్రాన్లు ఉన్నాయో తెలుసుకోవడం, ఆ మూలకంలో కణాలు క్రమంగా ఉన్నాయా లేదా ఐసోటోప్లో ఉన్నాయో లేదో తెలుసుకోవడానికి మీకు సహాయపడుతుంది, ఇందులో ఎక్కువ లేదా తక్కువ న్యూట్రాన్లు ఉంటాయి. అణువులోని న్యూట్రాన్ల సంఖ్యను నిర్ణయించడం చాలా సులభం మరియు ప్రయోగం అవసరం లేదు. సాధారణ అణువు లేదా ఐసోటోప్లోని న్యూట్రాన్ల సంఖ్యను లెక్కించడానికి, చేతిలో ఆవర్తన పట్టికతో ఈ సూచనలను అనుసరించండి.
స్టెప్స్
2 యొక్క పద్ధతి 1: ఒక సాధారణ అణువులోని న్యూట్రల్స్ సంఖ్యను కనుగొనడం
ఆవర్తన పట్టికలో మూలకాన్ని గుర్తించండి. ఈ ఉదాహరణ కోసం, ఆరవ వరుసలో ఉన్న OS (Os) ను పై నుండి క్రిందికి చూద్దాం.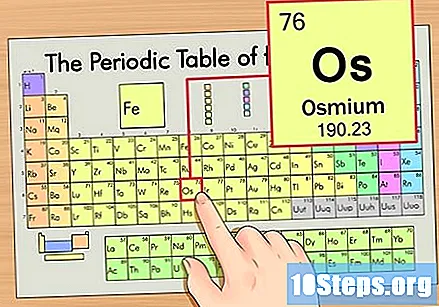
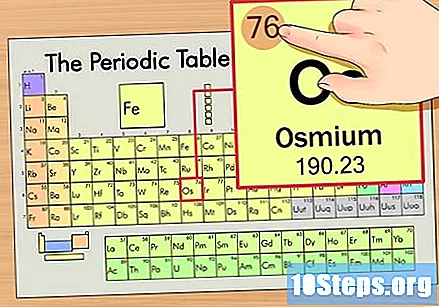
మూలకం యొక్క పరమాణు సంఖ్యను కనుగొనండి. ఇది సాధారణంగా ఒక నిర్దిష్ట మూలకానికి ఎక్కువగా కనిపించే సంఖ్య మరియు సాధారణంగా దాని గుర్తుకు పైన ఉంటుంది (మనం ఉపయోగిస్తున్న పట్టికలో, వాస్తవానికి, జాబితా చేయబడిన ఇతర సంఖ్య లేదు). పరమాణు సంఖ్య ఆ మూలకం యొక్క ఒకే అణువులోని ప్రోటాన్ల సంఖ్య. ఓస్ సంఖ్య 76, అంటే ఓస్మియం అణువులో 76 ప్రోటాన్లు ఉన్నాయి.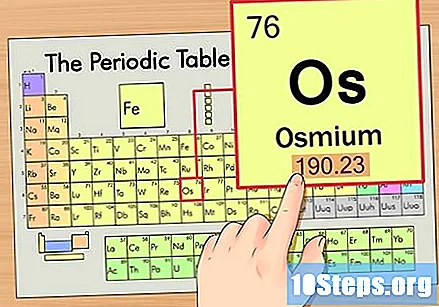
మూలకం యొక్క పరమాణు బరువును కనుగొనండి. ఈ సంఖ్య సాధారణంగా పరమాణు చిహ్నం క్రింద కనిపిస్తుంది. ఈ ఉదాహరణలోని పట్టిక అణు సంఖ్యపై మాత్రమే ఆధారపడి ఉంటుందని మరియు అణు బరువును జాబితా చేయదని గమనించండి. ఇది ఎల్లప్పుడూ అలా ఉండదు. ఓస్మియం 190.23 యొక్క అణు బరువును కలిగి ఉంది.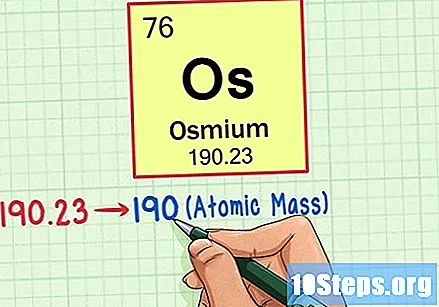
పరమాణు ద్రవ్యరాశిని కనుగొనడానికి అణు బరువును సమీప మొత్తం సంఖ్యకు రౌండ్ చేయండి. మా ఉదాహరణలో, 190.23 190 కు గుండ్రంగా ఉంటుంది, దీని ఫలితంగా ఓస్మియంకు 190 అణు ద్రవ్యరాశి ఉంటుంది.- పరమాణు ద్రవ్యరాశి మూలకం యొక్క ఐసోటోపుల సగటు. కాబట్టి, ఇది సాధారణంగా పూర్ణాంకం కాదు.
పరమాణు ద్రవ్యరాశి నుండి పరమాణు సంఖ్యను తీసివేయండి. అణువు యొక్క ద్రవ్యరాశిలో ఎక్కువ భాగం దాని ప్రోటాన్లు మరియు న్యూట్రల్స్లో కనబడుతున్నందున, పరమాణు ద్రవ్యరాశి నుండి ప్రోటాన్ల సంఖ్యను (అంటే పరమాణు సంఖ్య) తీసివేయడం మీకు సంఖ్యను ఇస్తుంది లెక్కించిన అణువులోని న్యూట్రాన్ల. దశాంశ బిందువు తరువాత ఉన్న సంఖ్య సాధారణంగా అణువులోని ఎలక్ట్రాన్ల యొక్క చాలా తక్కువ ద్రవ్యరాశిని సూచిస్తుంది. మా ఉదాహరణలో, ఇది: 190 (పరమాణు ద్రవ్యరాశి) - 76 (ప్రోటాన్ల సంఖ్య) = 114 (న్యూట్రాన్ల సంఖ్య).
సూత్రాన్ని గుర్తుంచుకో. భవిష్యత్తులో న్యూట్రాన్ల సంఖ్యను కనుగొనడానికి, ఈ సూత్రాన్ని ఉపయోగించండి: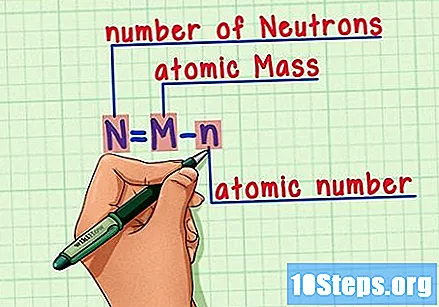
- N = M - n.
- N = సంఖ్య Neutrons.
- మ = Mఅణు కాల్చు.
- n = nఅణు హ్యూమరస్.
- N = M - n.
2 యొక్క విధానం 2: ఐసోటోప్లోని న్యూట్రాన్ల సంఖ్యను కనుగొనడం
ఆవర్తన పట్టికలో మూలకాన్ని గుర్తించండి. ఉదాహరణకు, కార్బన్ -14 ఐసోటోప్ను ఉపయోగిద్దాం. కార్బన్ -14 యొక్క ఐసోటోపిక్ కాని రూపం కేవలం కార్బన్ (సి) కనుక, ఈ మూలకాన్ని ఆవర్తన పట్టికలో (రెండవ వరుసలో) కనుగొనండి.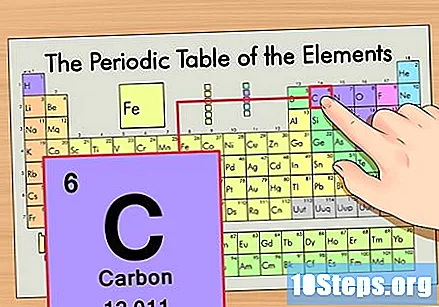
మూలకం యొక్క పరమాణు సంఖ్యను కనుగొనండి. ఇది సాధారణంగా ఒక నిర్దిష్ట మూలకానికి ఎక్కువగా కనిపించే సంఖ్య మరియు సాధారణంగా దాని గుర్తుకు పైన ఉంటుంది (మనం ఉపయోగిస్తున్న పట్టికలో, వాస్తవానికి, జాబితా చేయబడిన ఇతర సంఖ్య లేదు). పరమాణు సంఖ్య ఆ మూలకం యొక్క ఒకే అణువులోని ప్రోటాన్ల సంఖ్య. సి సంఖ్య 6, అంటే కార్బన్ అణువులో 6 ప్రోటాన్లు ఉంటాయి.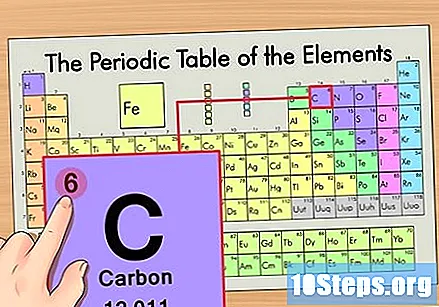
పరమాణు ద్రవ్యరాశిని కనుగొనండి. ఐసోటోపులతో ఇది చాలా సులభం, ఎందుకంటే వాటి పరమాణు ద్రవ్యరాశి పేరు పెట్టబడింది. కార్బన్ -14 యొక్క పరమాణు ద్రవ్యరాశి 14 ఉంది. మీరు ఐసోటోప్ యొక్క పరమాణు ద్రవ్యరాశిని కనుగొన్న తర్వాత, న్యూట్రాన్ల సంఖ్యను కనుగొనే ప్రక్రియ సాధారణ అణువులకు ఉపయోగించే మాదిరిగానే ఉంటుంది.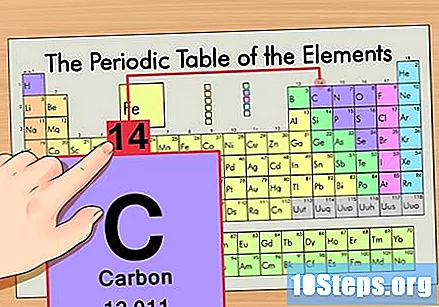
పరమాణు ద్రవ్యరాశి నుండి పరమాణు సంఖ్యను తీసివేయండి. అణువు యొక్క ద్రవ్యరాశిలో ఎక్కువ భాగం దాని ప్రోటాన్లు మరియు న్యూట్రల్స్లో కనబడుతున్నందున, పరమాణు ద్రవ్యరాశి నుండి ప్రోటాన్ల సంఖ్యను (అంటే పరమాణు సంఖ్య) తీసివేయడం మీకు సంఖ్యను ఇస్తుంది లెక్కించిన అణువులోని న్యూట్రాన్ల. దశాంశ బిందువు తరువాత ఉన్న సంఖ్య సాధారణంగా అణువులోని ఎలక్ట్రాన్ల యొక్క చాలా తక్కువ ద్రవ్యరాశిని సూచిస్తుంది. మా ఉదాహరణలో, ఇది: 14 (పరమాణు ద్రవ్యరాశి) - 6 (ప్రోటాన్ల సంఖ్య) = 8 (న్యూట్రాన్ల సంఖ్య).
సూత్రాన్ని గుర్తుంచుకో. భవిష్యత్తులో న్యూట్రాన్ల సంఖ్యను కనుగొనడానికి, ఈ సూత్రాన్ని ఉపయోగించండి: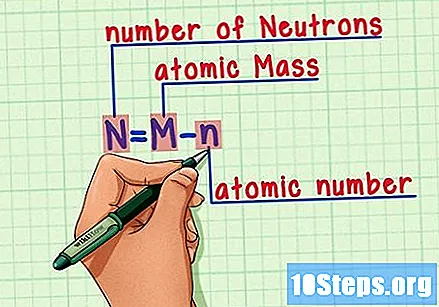
- N = M - n.
- N = సంఖ్య Neutrons.
- మ = Mఅణు కాల్చు.
- n = nఅణు హ్యూమరస్.
- N = M - n.
చిట్కాలు
- గది ఉష్ణోగ్రత వద్ద ఘన లోహమైన ఓస్మియం, గ్రీకు పదం 'వాసన', 'ఓస్మే' నుండి వచ్చింది.
- ప్రోటాన్లు మరియు న్యూట్రాన్లు మూలకాల యొక్క మొత్తం బరువును కలిగి ఉంటాయి, ఎలక్ట్రాన్లు మరియు ఇతర విభిన్న కణాలు అతితక్కువ ద్రవ్యరాశిని సూచిస్తాయి (సున్నా ద్రవ్యరాశికి చేరుకుంటుంది). ఒక ప్రోటాన్ తటస్థంగా ఉండే బరువు మరియు అణు సంఖ్య ప్రోటాన్ల సంఖ్యను సూచిస్తుంది కాబట్టి, మేము మొత్తం ద్రవ్యరాశి నుండి ప్రోటాన్ల సంఖ్యను తీసివేయవచ్చు.
- ఆవర్తన పట్టికలో ఏ సంఖ్య ఉందో మీకు తెలియకపోతే, ఇది సాధారణంగా పరమాణు సంఖ్య (అంటే ప్రోటాన్ల సంఖ్య) చుట్టూ తయారవుతుందని గుర్తుంచుకోండి, ఇది 1 (హైడ్రోజన్) తో మొదలై ఒక యూనిట్ పెరుగుతుంది ఎడమ నుండి కుడికి, 118 (Ununóctio) తో ముగుస్తుంది. ఎందుకంటే అణువులోని ప్రోటాన్ల సంఖ్య ఆ అణువు ఏమిటో నిర్ణయిస్తుంది, ఇది ఎలిమెంటల్ లక్షణాన్ని నిర్వహించడం సులభం చేస్తుంది (ఉదాహరణకు, 2 ప్రోటాన్లతో కూడిన అణువు ఎల్లప్పుడూ హీలియం అవుతుంది, 79 ప్రోటాన్లతో మరొక అణువు ఎల్లప్పుడూ బంగారంగా ఉంటుంది).