
విషయము
ప్రోటాన్లు, న్యూట్రాన్లు మరియు ఎలక్ట్రాన్లు అణువును ఏర్పరుస్తున్న మూడు ప్రధాన కణాలు. వారి పేర్లు సూచించినట్లుగా, మునుపటివి సానుకూలంగా వసూలు చేయబడతాయి, తరువాతి వాటికి ఛార్జ్ లేదు (అవి తటస్థంగా ఉంటాయి) మరియు మూడవది ప్రతికూల చార్జ్ కలిగి ఉంటుంది. ఎలక్ట్రాన్లు చాలా తక్కువ ద్రవ్యరాశిని కలిగి ఉంటాయి, ప్రోటాన్లు మరియు న్యూట్రాన్లు దాదాపు ఒకేలా ద్రవ్యరాశిని కలిగి ఉంటాయి. ఆవర్తన పట్టిక నుండి సమాచారాన్ని మాత్రమే ఉపయోగించి మీరు వాటిలో ప్రతి సంఖ్యను అణువులో కనుగొనవచ్చు.
దశలు
పార్ట్ 1 యొక్క 2: ప్రోటాన్లు, ఎలక్ట్రాన్లు మరియు న్యూట్రాన్లను లెక్కిస్తోంది
ఆవర్తన పట్టికను పొందండి. ఇది అణు నిర్మాణం ద్వారా మూలకాలను నిర్వహించే చిత్రం. ఇది రంగుల ద్వారా వర్గీకరించబడింది మరియు ప్రతి మూలకానికి ఒకటి, రెండు లేదా మూడు అక్షరాల ప్రత్యేక సంక్షిప్తీకరణను ఇస్తుంది. ఇతర సమాచారంలో పరమాణు ద్రవ్యరాశి మరియు సంఖ్య ఉన్నాయి.
- మీరు ఆవర్తన పట్టికను ఆన్లైన్లో లేదా కెమిస్ట్రీ పుస్తకంలో కనుగొనవచ్చు.
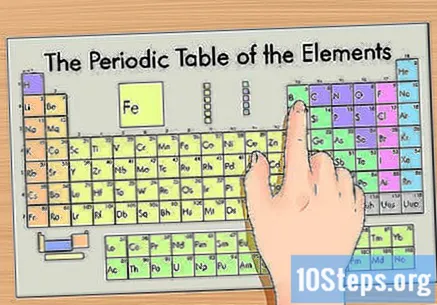
ఆవర్తన పట్టికలో మీ మూలకాన్ని కనుగొనండి. ఇది మూలకాలను అణు సంఖ్య ద్వారా నిర్వహిస్తుంది మరియు వాటిని మూడు ప్రధాన సమూహాలుగా వేరు చేస్తుంది: లోహాలు, లోహాలు కాని మరియు లోహలోయిడ్లు (సెమీ లోహాలు). ఇతర సమూహాలలో క్షార లోహాలు, హాలోజెన్లు మరియు గొప్ప వాయువులు ఉన్నాయి.- సమూహం (నిలువు వరుసలు) లేదా వ్యవధి (అడ్డు వరుసలు) ఉపయోగించడం వల్ల పట్టికలో మూలకాన్ని సులభంగా కనుగొనవచ్చు.
- మీకు ఇతర లక్షణాలు తెలియకపోతే మీరు మూలకం యొక్క చిహ్నం కోసం కూడా శోధించవచ్చు.
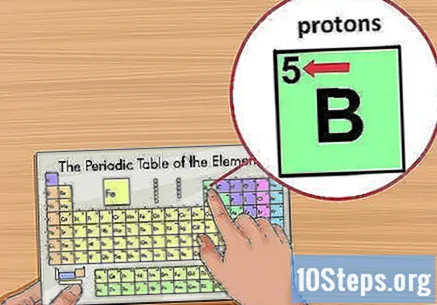
పరమాణు సంఖ్యను గుర్తించండి. ఇది మూలకం చిహ్నం పైన, చదరపు ఎగువ ఎడమ మూలలో ఉంది. ఆ మూలకం యొక్క ఒకే అణువులో ఎన్ని ప్రోటాన్లు ఏర్పడతాయో పరమాణు సంఖ్య మీకు తెలియజేస్తుంది.- ఉదాహరణకు, బోరాన్ (బి) అణు సంఖ్య 5 ను కలిగి ఉంది మరియు అందువల్ల ఐదు ప్రోటాన్లు ఉన్నాయి.
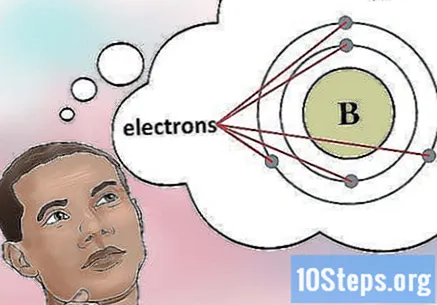
ఎలక్ట్రాన్ల సంఖ్యను నిర్ణయించండి. ప్రోటాన్లు సానుకూల చార్జ్ కలిగిన అణువు యొక్క కేంద్రకంలో కణాలు. ఎలక్ట్రాన్లు ప్రతికూలంగా చార్జ్ చేయబడిన కణాలు. కాబట్టి, తటస్థ మూలకం అదే సంఖ్యలో ప్రోటాన్లు మరియు ఎలక్ట్రాన్లను కలిగి ఉంటుంది.- ఉదాహరణకు, బోరాన్ (బి) పరమాణు సంఖ్య 5 ను కలిగి ఉంది మరియు అందువల్ల ఐదు ప్రోటాన్లు మరియు ఐదు ఎలక్ట్రాన్లు ఉన్నాయి.
- అయినప్పటికీ, మూలకం సానుకూల లేదా ప్రతికూల అయాన్ను కలిగి ఉంటే, ప్రోటాన్లు మరియు ఎలక్ట్రాన్లు ఒకేలా ఉండవు. మీరు వాటిని లెక్కించాల్సి ఉంటుంది. మూలకం తర్వాత అయాన్ సంఖ్య చిన్న సూపర్స్క్రిప్ట్గా కనిపిస్తుంది.
పరమాణు ద్రవ్యరాశి కోసం చూడండి. న్యూట్రాన్ల సంఖ్యను కనుగొనడానికి, మీరు మొదట పరమాణు ద్రవ్యరాశిని కనుగొనాలి. ఈ విలువ ఒక మూలకం యొక్క అణువుల సగటు ద్రవ్యరాశి మరియు మూలకం యొక్క చిహ్నం క్రింద కనుగొనవచ్చు.
- పరమాణు ద్రవ్యరాశిని తదుపరి మొత్తం సంఖ్యకు రౌండ్ చేయండి. ఉదాహరణకు, బోరాన్ యొక్క పరమాణు ద్రవ్యరాశి 10.811, కానీ మీరు దానిని 11 వరకు రౌండ్ చేయవచ్చు.
పరమాణు ద్రవ్యరాశి నుండి పరమాణు సంఖ్యను తీసివేయండి. న్యూట్రాన్ల సంఖ్యను కనుగొనడానికి, మీరు పరమాణు సంఖ్యను ద్రవ్యరాశి నుండి తీసివేయాలి. అణు సంఖ్య ప్రోటాన్ల సంఖ్యకు సమానమని గుర్తుంచుకోండి, ఇది ఇప్పటికే గుర్తించబడింది.
- మా బోరాన్ ఉదాహరణ కోసం, 11 (పరమాణు ద్రవ్యరాశి) - 5 (పరమాణు సంఖ్య) = 6 న్యూట్రాన్లు
2 యొక్క 2 వ భాగం: అయాన్లతో ఎలక్ట్రాన్లను లెక్కిస్తోంది
అయాన్ల సంఖ్యను గుర్తించండి. ఇది మూలకం తర్వాత చిన్న సూపర్స్క్రిప్ట్ విలువగా కనిపిస్తుంది. అయాన్ అనేది ఎలక్ట్రాన్ల కలయిక లేదా తొలగింపు కారణంగా సానుకూల లేదా ప్రతికూల చార్జ్ కలిగిన అణువు. ఒక అయాన్లో, ప్రోటాన్ల సంఖ్య ఒకే విధంగా ఉన్నప్పటికీ, ఎలక్ట్రాన్ల సంఖ్య మారుతుంది.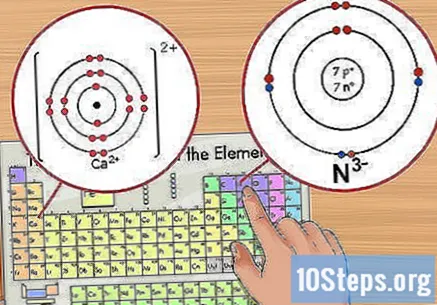
- ఎలక్ట్రాన్ ప్రతికూల చార్జ్ కలిగి ఉన్నందున, అది తొలగించబడినప్పుడు, అయాన్ సానుకూలంగా మారుతుంది. ఎక్కువ ఎలక్ట్రాన్లు జతచేయబడినప్పుడు, అయాన్ ప్రతికూలంగా మారుతుంది.
- ఉదాహరణకు, N కి -3 ఛార్జ్ ఉంటుంది, Ca కి +2 ఛార్జ్ ఉంటుంది.
- మూలకం తర్వాత సూపర్స్క్రిప్ట్ సంఖ్య లేకపోతే మీరు ఈ గణన చేయనవసరం లేదని గుర్తుంచుకోండి.
పరమాణు సంఖ్య నుండి ఛార్జీని తీసివేయండి. ఒక అయాన్ సానుకూల చార్జ్ కలిగి ఉన్నప్పుడు, అణువు ఎలక్ట్రాన్లను కోల్పోయింది. వాటిలో మిగిలిన మొత్తాన్ని లెక్కించడానికి, పరమాణు సంఖ్య నుండి అదనపు ఛార్జ్ మొత్తాన్ని తీసివేయండి. సానుకూల అయాన్ విషయంలో, ఎలక్ట్రాన్ల కంటే ఎక్కువ ప్రోటాన్లు ఉన్నాయి.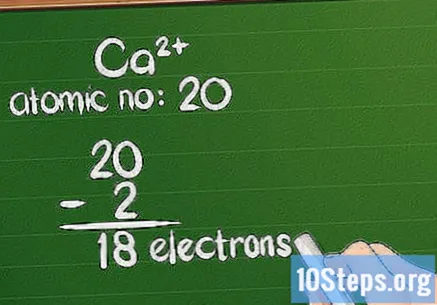
- ఉదాహరణకు, Ca కి +2 ఛార్జ్ ఉంది, కాబట్టి ఇది దాని సహజ స్థితి నుండి 2 ఎలక్ట్రాన్లను కోల్పోయింది. కాల్షియం యొక్క పరమాణు సంఖ్య 20, కాబట్టి అయాన్ 18 ఎలక్ట్రాన్లను కలిగి ఉంటుంది.
ప్రతికూల అయాన్ల కోసం పరమాణు సంఖ్యకు ఛార్జీని జోడించండి. ఒక అయాన్ ప్రతికూల చార్జ్ కలిగి ఉన్నప్పుడు, అణువు ఎలక్ట్రాన్లను పొందింది. వాటి మొత్తం సంఖ్యను లెక్కించడానికి, మీరు పరమాణు సంఖ్యకు అదనపు ఛార్జీ మొత్తాన్ని జోడించండి. ప్రతికూల అయాన్ విషయంలో, ఎలక్ట్రాన్ల కంటే తక్కువ ప్రోటాన్లు ఉన్నాయి.
- ఉదాహరణకు, N కి -3 ఛార్జ్ ఉంది, కాబట్టి దాని తటస్థ స్థితితో పోల్చినప్పుడు ఇది మూడు ఎలక్ట్రాన్లను పొందింది. నత్రజని యొక్క పరమాణు సంఖ్య 7, కాబట్టి ఈ అయాన్ 10 ఎలక్ట్రాన్లను కలిగి ఉంటుంది.


